【研究紹介はこちらの動画でもチェック!】
私たちの研究目的は、さまざまな生命現象を制御する分子ネットワークであるシグナル伝達機構・代謝制御機構の仕組みを定量的に記述して統合的に「システム」として理解することです。私たちは実験的方法とコンピュータ・シミュレーションの両方を用いてシステム生物学という観点から細胞の機能を理解しようとしています。
シグナル伝達ネットワークの本質は、多彩な入力の情報を限られた種類の分子にコードすることにあります。私たちはERK経路やAKT経路、インスリンシグナリングなどが、分子活性の時間パターンに入力情報がコードすることにより多彩な生理機能を制御する「時間情報コード」を世界に先駆け見出しています。本研究室では、「時間情報コード」の観点からシグナル伝達ネットワークの情報処理の仕組みを明らかにすることを目的としています。 これらの解析には従来の分子細胞生物学的実験だけでなく、微分方程式を用いたシミュレーションや、統計モデル、情報理論などさまざま数理解析手法を用います。これらの手法は、これまでの知識に基づき仮説を立て検証するという仮説駆動型のアプローチです。これまでの生命科学では一般的な方法です。
生命科学では「情報」という言葉は定義がなくあいまいなまま用いられています。一方、情報理論では「情報」をエントロピーとして定義することが可能です。私たちが開発した自動化定量測定技術QIC(Quantitative Image Cytometry)により、シグナル伝達ネットワークが何ビットの情報を伝達可能か計測できるようになりました。これによりシグナル伝達ネットワークの情報通信路としての特性が初めて明らかになると期待されます。
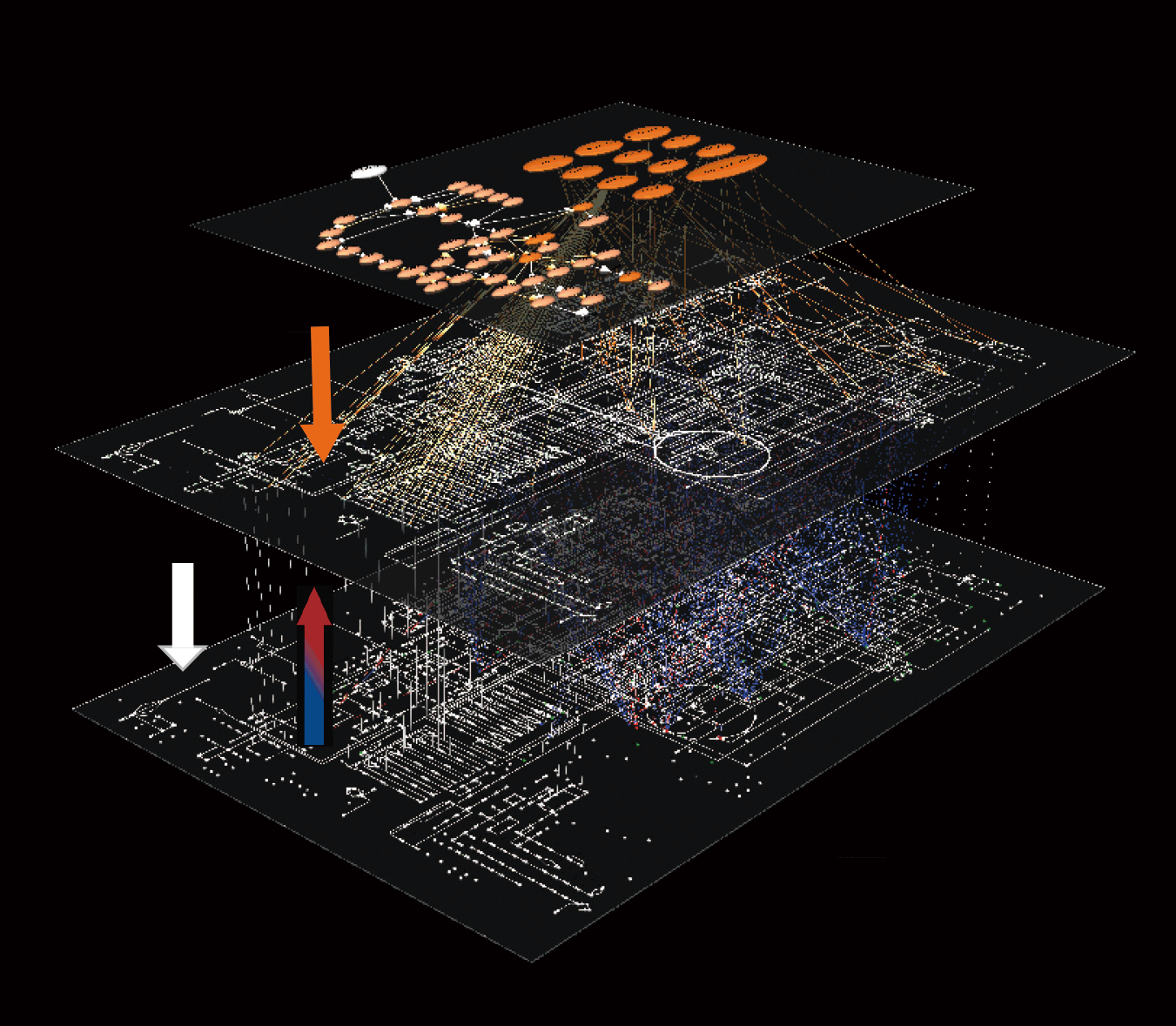
これまでの解析では、個々の研究結果を統合してシステムの全体像を描いてきました(ボトムアップアプローチ)。しかし、これではさまざまな矛盾が生じることが明らかとなってきました。その主な原因は、個々の研究では測定分子の網羅性と多階層性が乏しいことと、実験条件が異なることにあります。したがって、各階層の分子を網羅的に計測する技術(オミクス技術)を結集して同一条件で計測し、そのデータを統合して解析を行うこと、すなわち、トランスオミクスが必要となってきています(トップダウンアプローチ)。これらの計測は単独研究室で行うことは不可能です。そこで、私たちはリン酸化プロテオミクス(九大、中山先生、松本先生との共同研究)とメタボロミクス(慶大、曽我先生)と協力して、同一条件でインスリンの作用のトランスオミクス計測を行い、リン酸化タンパク質による代謝制御のグローバルネットワークをオミクスデータから人手を解さず自動的にアンバイアスに再構築する手法を確立しました。トランスオミクスは、大規模データをあるアルゴリズムに則り計算機によりアンバイアスに解析するデータ駆動型のアプローチです。最近発展してきているビッグデータの解析と同じコンセプトを持つアプローチです。また、各オミクス解析はとてもひとつの研究室でできるものではなく、さまざまな研究室との共同研究を行っている点も私たちの研究室の特徴のひとつです。
このようにシグナル伝達機構・代謝制御機構は要素も多く複雑な相互作用により成り立っているため、実験観測で得られる個々の分子の情報を生命現象に関連づけるボトムアップの手法のみでは実際のところなかなか理解できません。逆に、トップダウン的に単なる入出力データから情報を抽出してモデルを推定する手法では多くの場合モデルを一意に決定できません。将来的には、トップダウンに同定したアンバイアスなグローバルネットワークを縮約して、ネットワークモチーフを同定して個別に解析して、時間情報コードの設計原理(design principle)を解明していきます。このようにボトムアップとトップダウンのアプローチを組み合わせるところが私たちの次のチャレンジのひとつです。
また、これまで(平成25年)は、主に哺乳類の培養細胞を対象としてきましたが、上記の時間情報コードとトランスオミクスを融合させることにより、現在では疾患モデルマウスや、ヒトのトランスオミクスデータなどの個体レベルの解析も行っており、研究結果を近いうちに発表できる段階まで来ています。システム生物学が、いよいよ医学や創薬にダイレクトに貢献できる時代がやってきました。これからの進歩が楽しみです。

[+] 拡大する
私たちの研究手法は、非常に多彩です。従来の分子細胞生物学的実験だけでなく、微分方程式を用いたシミュレーションや、システム同定、統計モデル、情報理論などさまざま数理解析手法を用います。これらの数理解析を行うためには、大量かつ高精度の計測データが必要です。そこで、ロボットや自動計測手法を導入して、極力人手によるばらつきを抑えるようなハイテク化を試み、自動化・ハイスループット化にも取り組んでいます。
1. インスリンシグナル伝達のトランスオミクス解析
2. インスリン作用の時間情報コーディング
3. 多細胞組織の情報伝達
4. 経口糖摂取に応答するヒト血中分子の時間パターン
1. インスリンシグナル伝達のトランスオミクス解析
生命システムが示す様々な表現型は、代謝物、タンパク質、mRNAなどの多階層にまたがる分子ネットワークによって調節されています。インスリンによる代謝制御はその好例で、シグナル伝達系が代謝酵素のリン酸化や転写制御を介して糖代謝を調節することが知られています。こうした多階層の調節メカニズムを解明するため、従来の生物学では一部の分子の周囲のみを多階層にわたって解析する研究や、一つの階層のみを網羅的に解析する研究を行ってきました(図1)。しかし、これらの従来のボトムアップアプローチは研究者の主観によって解析対象にバイアスがかかるため、鍵となる経路や分子を取り逃がす可能性が否めません。
このようなボトムアップアプローチの限界を克服するため、我々は複数階層を網羅的に測定し、多階層にまたがる大規模ネットワークを再構築するトップダウンアプローチである「トランスオミクス解析」の手法を確立しました(図1)(柚木ら, 2014, プレスリリース、川田ら, 2018, プレスリリース、柚木ら, 2016)。メタボローム(慶大・曽我研との共同研究)やリン酸化プロテオーム(九大・中山研との共同研究)といった「細胞のビッグデータ」から、多階層にまたがるインスリンの代謝調節経路をデータドリブンに再構築した結果、インスリンによる調節がこれまで考えられていたよりも広い範囲のネットワークに及ぶことが明らかとなりました(図2)。さらに、再構築したインスリン代謝制御ネットワークを数理モデルと分子生物学実験により解析した結果、肝臓のみで機能する新規経路を発見しました。
我々はこのトランスオミクス解析手法をマウスの肝臓に対して適用し、健常マウスと肥満モデルマウスの肝臓において、グルコース投与時または空腹時にみられる大規模代謝制御ネットワークを明らかにしました(小鍛治ら, 2020, プレスリリース、江上ら, 2021, プレスリリース)。そして、健常マウスの代謝はAkt経路を介した遺伝子発現と代謝物自身により速く制御され、一方肥満マウスでは速い代謝制御の多くが失われ、遺伝子発現による遅い代謝制御が糖代謝・脂質代謝等で活性化することを見出しました。
この方法論は、インスリンに限らず広くシグナル伝達を介する代謝制御ネットワークの再構築に応用することが可能です。また、細胞や肝臓のみならず、他の臓器や個体レベルのネットワーク再構築にも利用可能です。この特性を生かし、今後は他の多階層調節メカニズムや、臓器、個体レベルのトランスオミクス解析も行っていきます。
図2
[+] 拡大する
2. インスリン作用の時間情報コーディング
細胞は限られたシグナル伝達経路を用いて外界変化という複雑で多くの刺激情報を処理しなくてはなりません。これを達成するために、細胞は活性化する経路の組み合わせにより情報を処理するという方法を用いていることが知られています。今までの研究から我々は、これに加え、分子の時間パターンに情報が埋め込まれ、細胞がその情報を処理しているという「時間情報コーディング」の概念を世界に先駆けて提唱しています。
図1
[+] 拡大する
インスリンは生体内において複数の応答を制御しており、その破綻は糖尿病を誘発することが知られています。また、血中のインスリンは複数の波形からなることが知られており(図1)、その生理学的意義も報告されていますが、これらの波形が生理作用に及ぼす分子メカニズムは不明でした。我々は「時間情報コーディング」の概念から、インスリンの血中波形に複数の情報がコードされ、そのインスリン波形がコードされた情報依存的に標的臓器の応答を個別に制御しているのではないかと考えました。そこでインスリンの最初の標的臓器であり、最も波形の影響を受けている肝臓細胞に注目し、実験とシミュレーションを用いて解析を行いました。その結果、インスリンの波形に埋め込まれた複数の情報が、一旦、インスリン作用において中心的な役割を担っているAKTの時間パターンに多重にコードされ、下流分子がそれらの情報をネットワーク構造やkineticsの違いによりデコードすることで、インスリン波形が下流の分子を個別に制御できることを明らかにしました(図1)(久保田ら、2012)。この様なメカニズムは、インスリンシグナル伝達経路に限らず他の経路にも存在する一般的なメカニズムであると考えられます。将来的には動物を用いた実験も行い、インスリン波形による情報処理機構を解明し、生体内における「時間情報コーディング」の概念の存在とそのメカニズムを明らかにすることを目的としています。
3. 多細胞組織の情報伝達
細胞は外部環境の刺激に応じて応答を制御して環境に適応していますが、シグナル伝達経路にはノイズが加わるために応答を正確に制御できない可能性があります。ノイズが加わる中でどれだけ正確に応答が可能であるかを評価するためには応答のばらつきを求めて情報理論解析を行い、以下の式によって相互情報量という値を求める必要があります。

[+] 拡大する
しかし、従来の研究では異なる細胞の応答が混在する中でばらつきを求めていたために、細胞ごとの応答のばらつき、細胞間変動と同じ細胞の中での応答のばらつき、細胞内変動を分離して解析することができませんでした。その結果、細胞内変動のみならず細胞間変動もノイズとして扱われてきました(図1A)。
図1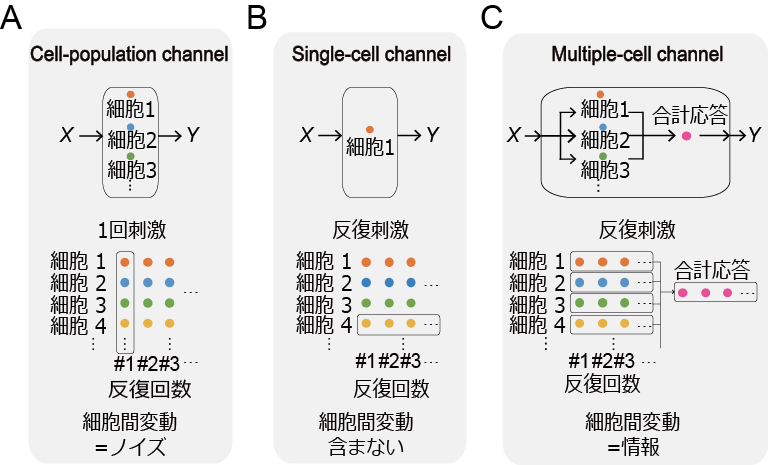
[+] 拡大する
そこで我々は、マウス骨格筋系培養細胞C2C12や単離筋線維に対して反復して刺激を加えることにより、細胞内変動と細胞間変動を分けて計測することに成功しました(図1B)(和田ら, 2020, プレスリリース)。さらに、多細胞生物にとってより自然な情報伝達の形である、多細胞の応答を足し合わせた組織としての応答を調べました(図1C)。すると興味深いことに、細胞間変動によって刺激強度の違いを細かく区別できるようになるため、細胞間変動がノイズであった従来研究とは異なり、組織としてはかえって正確な応答制御が可能になることがわかりました(図2)。この効果を我々は「応答多様性効果」と名付けました。さらに、ヒト生体内において、顔面神経への電気刺激による表情筋の筋電図計測により、生体内の筋肉は各細胞よりも正確に応答していることも示しました。細胞ごとの応答のばらつきによる正確な応答制御機構が明らかになったことで、臓器レベルの応答制御がより明らかになっていくものと考えられ、疾病などによる臓器の応答制御異常のメカニズム解明にも役立っていくものと考えています。
図2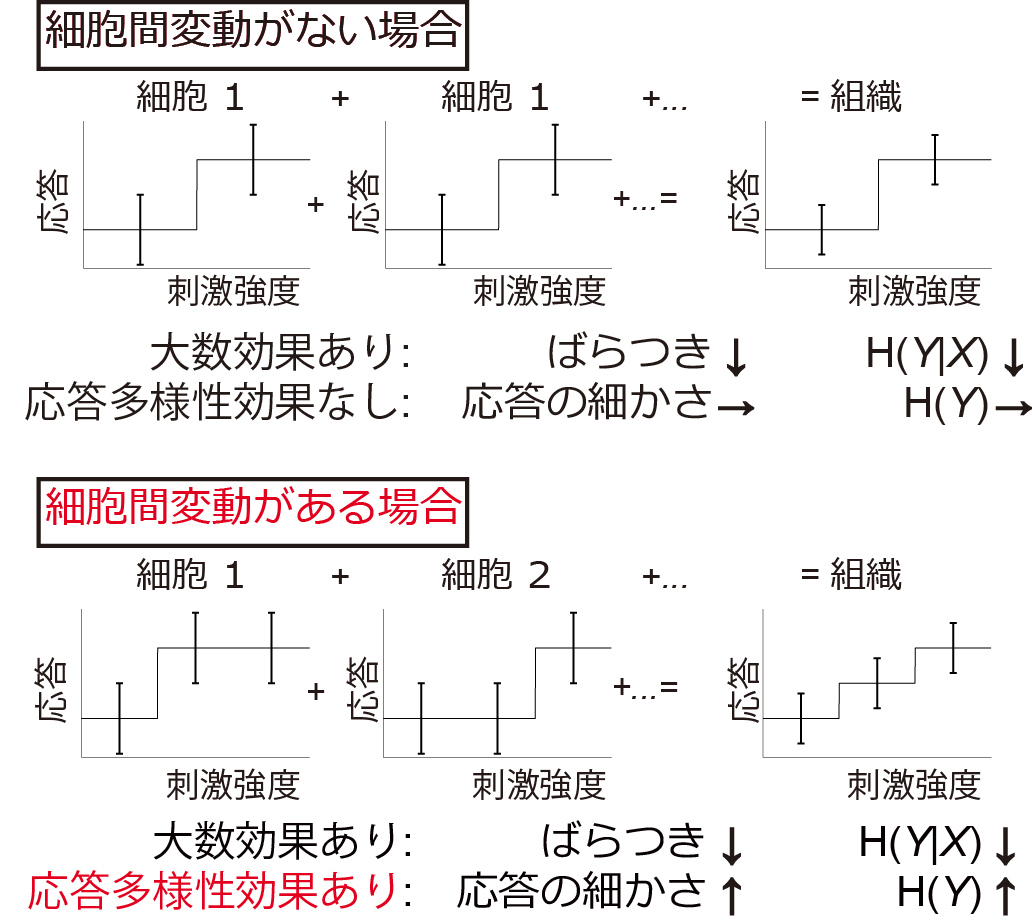
[+] 拡大する
4. 経口糖摂取に応答するヒト血中分子の時間パターン
我々は糖摂取後のヒト血中代謝物・ホルモン濃度に着目した研究も行っています。食事や経口糖摂取により、ヒト血糖は増加するとともに、肝臓・筋肉などで貯蔵・放出され、それらの作用は血中ホルモンにより促進・抑制されます。中心的な血糖値制御ホルモンであるインスリンは血糖値の上昇を抑制するだけでなく、アミノ酸や脂質など、他の多くの代謝物の代謝の制御にも関与しています。しかし、経口糖摂取前後の包括的な代謝物およびホルモンの詳細な時間変化(=時間パターン)の特徴はまだ特徴付けられていません。そこで我々は、糖摂取後の健康なヒトの、個人間および分子間における、包括的な代謝物とホルモンの時間パターンを次のように特徴付けました(図1、 藤田ら, 論文査読中、慶大・曽我研との共同研究)。1)大きさや早さなどの時間成分、2)個人間の時間パターンの類似性、3)個人間の大小関係の時間変化、4)分子間の時間パターンの類似性。
その結果、アミノ酸の時間パターンは個人間、分子間ともに類似し、個人間の大小関係が時間に対し一定であったため、代謝制御が個人間で類似していることが示唆されました。対して、糖代謝関連分子や脂質の時間パターンは個人間で類似するが、分子間では異なり、個人間の大小関係が頻繁に変化するため、代謝制御が異なることが示唆されました。個人間・分子間の代謝制御の違いを反映するこれら4つの指標は、個人間における全身の糖代謝の生理・病理を理解し、将来の個別化医療のための新たな手がかりとなることが期待されます。
図1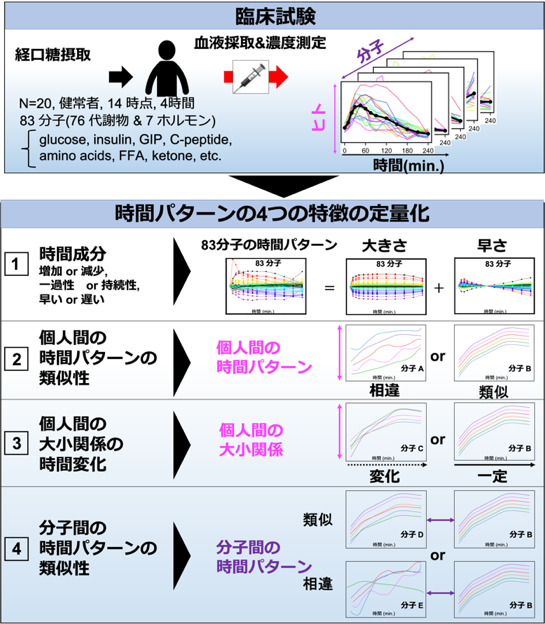
[+] 拡大する
この他にも、我々は対象分子を絞った、糖摂取後の分子濃度の動的な関係を数理モデルによって記述した研究も行ってきました。例えば、摂取量や摂取時間を変更した、糖摂取後のヒト血中分子濃度の時間パターンを用いて、血糖値制御を数理モデルによって記述した研究(藤井ら、2019)では、血糖値のピーク値を最小にする最適な糖摂取パターンは、30分間隔の間欠摂取であることが予測されました。また、健常者・境界型・2型糖尿病患者の計111名に臨床試験を行い、高血糖クランプと高インスリン正常血糖クランプを行った血中分子濃度の時間パターンを用いた、血中グルコース・インスリンのフィードバック制御を数理モデルによって記述した研究(大橋ら、2018,2015、神戸大・小川研との共同研究)では、血中インスリン除去作用が2型糖尿病の進行に関わることを、初めて示しました(図2)。このように、ヒト臨床試験によって得られた血中分子濃度の時間パターンを用いて、分子間の制御関係を数理モデルによって記述することで、適切な健康管理方法の考案や、ヒト生体内での分子の働き度合い(作用強度)や分子作用間のメカニズムを解明できると考えています。
図2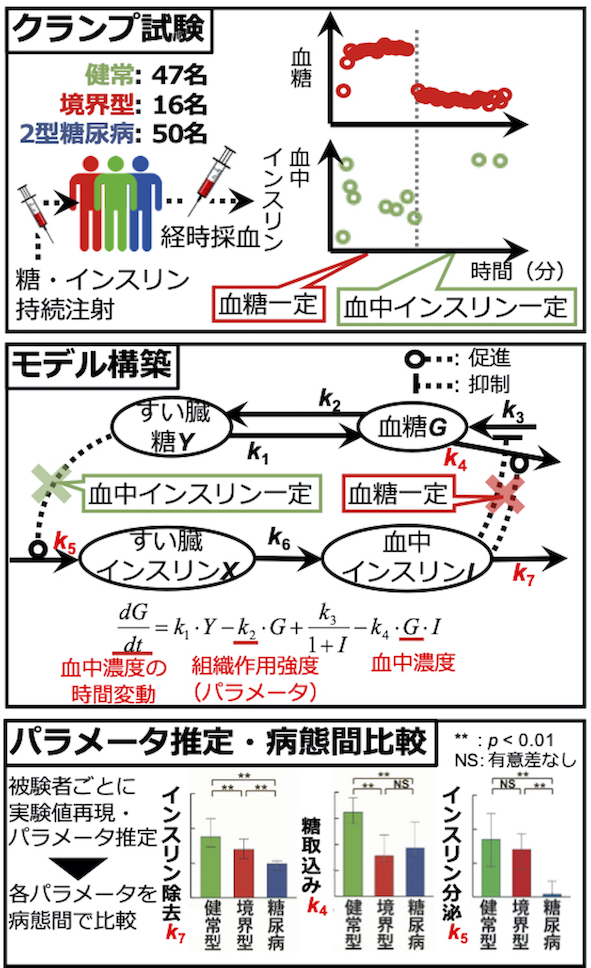
[+] 拡大する

